Autores:
Introdução
As artroplastias totais de joelho (ATJ) são realizadas com muita frequência nos dias atuais, com excelentes resultados em relação à sobrevida do implante acima de 15 anos (1-2). As taxas anuais de ATJ estão aumentando progressivamente, pois a população está vivendo mais e são realizadas cirurgias em pacientes cada dia mais jovens. Um estudo (3) mostra as projeções de revisões de ATJ nos Estados Unidos que irão duplicar até o ano de 2015 e terão aumento em torno de 600% até o ano de 2030.
Em torno de 5% observam-se falhas da ATJ, representando um número substancial, onde os cirurgiões ortopedistas estão observando um aumento do número de pacientes que inicialmente tinham uma ATJ muito satisfatória e com o passar do tempo apresentam dor, evidências radiográficas de soltura de algum componente e/ou incapacidade funcional devido à falência da sua ATJ (4).
Quando comparamos as cirurgias de ATJ primárias com as revisões, observamos que o procedimento é tecnicamente mais difícil com maiores riscos de complicações. Frente a isto, é necessária uma abordagem sistemática para melhor definição da etiologia da falha, diagnóstico correto e também fazer um planejamento mais preciso para que a cirurgia tenha maior chance de sucesso.
Antes de realizarmos uma revisão, devemos tentar conhecer a causa da dor pós-ATJ, uma vez que cirurgias de revisão por dores inexplicáveis têm poucas chances de apresentar resultados satisfatórios (5). O cirurgião deve procurar identificar os implantes, bem como procurar por possíveis comorbidades para que o paciente apresente boas condições para a cirurgia de revisão. Uma boa cicatrização da ferida operatória é crítica após uma revisão de ATJ. Se existir alguma dúvida, deve-se pedir o auxílio de um cirurgião plástico para avaliar a necessidade de possível retalho musculo- cutâneo.
Avaliação da dor pós-ATJ
A etiologia da dor e/ou incapacidade funcional pós-ATJ pode ser variada e numerosa, levando-nos a uma análise criteriosa e sistemática para melhor definir o diagnóstico (6-7-8). Uma boa abordagem deve levar em conta: história, exame físico, exames de imagem e laboratoriais para definição da possível causa de falha. As etiologias podem ser agrupadas em duas categorias: intrínsecas ou intra-articulares e extrínsecas ou extra-articulares (9).
– Intrínsecas / intra-articulares: infecção, instabilidade, mau alinhamento, soltura asséptica, desgaste polietileno, osteólise, fratura do implante, artrofibrose, interposição de tecidos moles, “clunk” patelar, implantes muito grandes (“overhang”), alterações do aparelho extensor (instabilidade patelar, fratura da patela, dor patelar, patela baixa, excesso de espessura da patela/implante e ruptura do tendão patelar ou quadricipital).
– Extrínsecas / extra-articulares: patologia do quadril e/ou coluna, neuroma, algodistrofia, claudicação vascular, processo inflamatório dos tecidos moles (bursites, tendinites) e fratura periprotética (fêmur, tíbia, patela).
História e Exame físico
A história e o exame físico são os primeiros pontos críticos na avaliação dos pacientes com dor e/ou incapacidade funcional pós-ATJ. Com frequência, somente com esta avaliação inicial podemos identificar ou eliminar possível etiologia. Os sintomas ou sinais iniciais (dor, derrame articular, instabilidade ou rigidez) devem ser bem esclarecidos, bem como quando surgem, quanto tempo de duração, qual a frequência e tipo de atividade que se manifestam. A dor que estava presente antes da cirurgia primária e que persiste sem modificação, sugere uma etiologia extrínseca. A dor que surge dentro do primeiro ano da cirurgia sugere infecção, má rotação dos componentes ou interposição de tecidos moles. A dor que aparece após o primeiro ano, sugere desgaste do polietileno, osteólise, soltura ou infecção (aguda hematogênica ou crônica). As comorbidades como, diabete, estenose lombar e doenças vasculares periféricas devem ser consideradas.
O exame físico deve incluir a inspeção visual, a palpação cuidadosa de pontos dolorosos ou derrame articular, testes de estabilidade em extensão, média flexão e 90° de flexão e finalmente a avaliação da estabilidade femoropatelar com possíveis pontos dolorosos da patela ou retináculas. Neste exame deve-se:
– ver / observar o paciente caminhar;
– mensurar o arco de movimento ativo e passivo;
– avaliar o “tracking” patelar;
– examinar a força muscular do quadríceps e vasto medial, bem como as condições neurovasculares do membro inferior;
– examinar as articulações adjacentes (coluna, quadril, tornozelo e pé, pois uma deformidade com pé plano-valgo pode levar à falência de prótese com retenção do ligamento cruzado posterior-LCP) (10).
Avaliação radiográfica
O exame das radiografias simples podem revelar muitas causas intrínsecas de dor em pacientes pós-ATJ e avaliar as radiografias seriadas feitas com o passar do tempo, incluindo do pré-operatório podem ser muito úteis para o diagnóstico. As radiografias longas incluindo quadril e tornozelo com apoio, perfil do joelho, axial da patela e quadril ipsilateral devem ser realizadas e avaliadas. As radiografias anteroposteriores podem mostrar desgaste do polietileno; osteólise; linhas radioluscentes; “overhang”, subsidência ou mudança de posição do componente tibial. As radiografias em perfil podem definir o tamanho do componente femoral, “offset” posterior do fêmur, altura e espessura patelar, “slope” do componente tibial e possível subsidência. O axial da patela pode mostrar inclinação da patela, mau alinhamento, “overhang” femoral, impacto femoropatelar lateral e a espessura do componente patelar. As radiografias seriadas são muito importantes e inestimáveis para definir sinais súbitos de soltura, como progressão tardia de linhas radioluscentes, mudanças ou fraturas no manto de cimento, progressão de osteólise ou mudança súbita da posição dos componentes.
O exame por fluoroscopia pode ser útil para avaliar a interface de próteses não cimentadas. A extensão da osteólise é melhor avaliada pela tomografia computadorizada(TAC) ou pela ressonância magnética (RNM) com supressão de artefatos metálicos, porém estes não estão universalmente disponíveis (11). A TAC e a RNM também podem ser usadas para avaliar a rotação dos componentes femoral e tibial; o componente femoral é comparado com o eixo transepicondilar e o componente tibial é comparado com o 1/3 médio do tuberosidade anterior tibial (TAT). A rotação interna excessiva dos componentes pode estar associada com a instabilidade patelar (12) e frouxidão lateral em flexão, levando a má função clínica do joelho. A avaliação por radionuclídeos (cintilografia óssea) pode ser útil para o diagnóstico de soltura asséptica, infecção, algodistrofia e fraturas periprotéticas por estresse. Estes exames não são específicos e podem levar a resultados falsos positivos nos primeiros anos de pós-operatório. A cintilografia com Tecnécio99 mostra hipercaptação em torno de 90% dos componentes tibiais e 65% dos femorais até um ano pós-ATJ (13). Os exames de cintilografia para o diagnóstico de infecção são inconclusivos, sejam eles com Tecnécio99 ou com Índio111, de acordo com estudos já publicados. O uso do Índio111 tem valor para a exclusão de infecção quando for negativo.
Pela facilidade, acurácia e o baixo custo da aspiração articular para análise do líquido sinovial e cultura, estes exames avançados de imagem devem ser usados somente como “segunda linha”, quando não é possível obter líquido sinovial pela aspiração (4).
Exames laboratoriais (pré-operatórios)
Todos os pacientes com falha ou dor pós-ATJ devem ser avaliados para infecção profunda periprotética. Mesmo se a causa da falha estiver evidente, infecção concomitante pode estar presente e o tratamento neste caso será totalmente diferente daquele de falha asséptica. O histórico médico do paciente e a história da cirurgia primária pode sugerir infecção. Os riscos relacionados ao paciente incluem diabete, artrite inflamatória, obesidade, história de infecção prévia no joelho, problemas de pele, cirurgias anteriores no joelho, desnutrição, insuficiência renal (principalmente com diálise) e imunodepressão. Os pacientes devem ser questionados sobre possível dificuldade de cicatrização da ferida operatória na cirurgia primária, uso prolongado de antibióticos ou retorno à sala de cirurgia. Se não houve alívio da dor desde a cirurgia, principalmente se é diferente da dor do pré-operatório, aumentam as suspeitas de infecção. Alguma doença recente que pode levar à bacteremia, pode indicar uma infecção hematogênica.
Na presença de soltura de algum componente da prótese dentro de dois a cinco anos de pós-operatório deve ser considerada a possibilidade de infecção.
Os exames básicos são a velocidade de eritrosedimentação (VHS) e o nível da proteína-C-reativa (PCR) que são sensitivos para identificar infecção, e é improvável que ambos estejam em níveis normais se houver infecção (14). Em estudos recentes (14-15) foi mostrado que se o VHS for menor que 30 mm/h e a PCR for menor que 10 mg/dL é improvável que haja infecção. Então, devemos avaliar cada paciente para identificar aqueles que necessitam de testes adicionais. Se só um dos testes é anormal ou a suspeita permanece alta, deve-se aspirar a articulação e fazer exame de Gram, cultura, contagem de células brancas e diferencial do líquido sinovial. O paciente não deve receber antibiótico por um mínimo de duas semanas antes da aspiração para “otimizar” os resultados da cultura. A aspiração deve ser repetida se existe alta suspeita clínica. A contagem de células brancas do líquido sinovial de uma ATJ entre 1100 e 3000 cel/mm3 é altamente sugestiva de infecção (16-17). A percentagem de neutrófilos no líquido aspirado também é um marcador sensível para infecção. Se a percentagem estiver entre 60 e 80%, infecção é muito provável. Quando a contagem de células brancas for menor que 1100 cel/mm3 e a percentagem de neutrófilos for menor que 64%, o valor preditivo negativo é de 98,2%; por outro lado, quando os valores estão acima que aqueles valores mencionados anteriormente, o valor preditivo positivo é de 98,6% para infecção (15). A determinação destes valores do líquido aspirado é de baixo custo, objetivo, pode ser realizado no pré ou no intraoperatório, com fácil acesso a qualquer cirurgião em qualquer parte do mundo.
Exames laboratoriais (intraoperatórios)
A aparência do local da cirurgia e a coloração pelo Gram mostraram ser pouco sensitivos para detectar possível infecção. O exame anatomopatológico de tecidos periprotéticos mostrou ser muito útil para o diagnóstico de infecção (18). Entretanto, para este exame ser acurado e sensitivo é necessário ter disponível um patologista experiente. O critério histológico para diagnóstico de infecção é controverso, mas no geral é aceito que mais que 10 polimorfonucleares por campo de grande aumento, o diagnóstico é infecção.
Planejamento pré-operatório
A cirurgia de revisão normalmente é mais difícil que as cirurgias primárias, porém com um planejamento adequado muitos cirurgiões podem realizá-la de maneira adequada e efetiva. O planejamento deve fazer parte de qualquer cirurgia, porém nas cirurgias de revisão de ATJ isto se faz muito mais necessário, para que surpresas não surjam durante a cirurgia, e se elas surgirem, as soluções já estejam presentes em nossa mente.
A avaliação da causa da dor (geralmente o sinal mais comum) após ATJ é crítica e fundamental para firmar um diagnóstico correto e planejar o tratamento mais adequado. Uma revisão de ATJ realizada sem diagnóstico preciso tem muita chance de levar a novo insucesso (19).
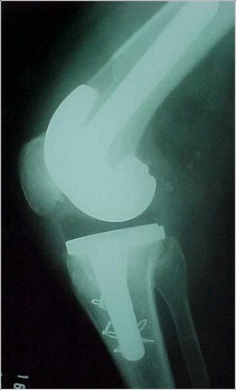
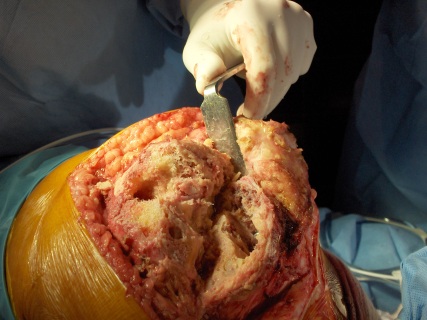
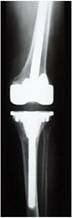
Um dos primeiros passos, é determinar a causa da falência, se existe ou não infecção presente (fig.1), através de RX, ex. laboratoriais, Cintilografia, punção articular, ou outros exames necessários.
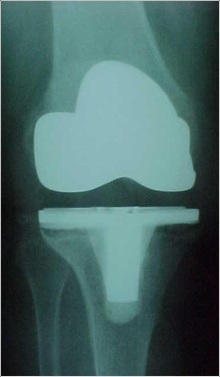
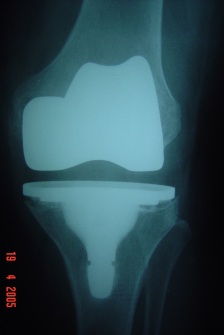
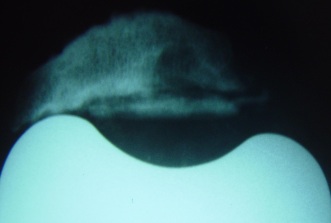
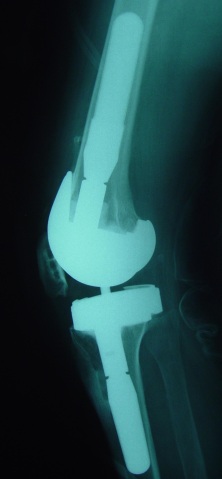
Devemos determinar que tipo de estabilidade (“constrição”) será necessária durante a cirurgia, ou seja, estabilização posterior, médio-lateral, articulada tipo “dobradiça”. A modularidade das próteses atuais nos permite uma customização adequada durante a cirurgia (fig.4).

Cirurgia prévia
– Que tipo de implante foi usado ?
– Qual era o tamanho do implante ?
– Tem história de calor local ou drenagem persistente na cirurgia primária ?
Infecção
– Os exames laboratoriais são sugestivos de infecção ?
– As alterações radiográficas sugerem infecção ?
– Cintilografia foi realizada ? É positiva ? Caso seja negativa = afasta infecção.
– Punção e cultura do material foram realizadas ?
– Se necessário, fazer biópsia de sinovial ou material articular para exame anatomo-patológico;
– Será utilizado cimento com antibiótico na cirurgia ? Já vem misturado com o cimento de fábrica ou será adicionado ? Está disponível ?
Exposição / Vias de acesso articular
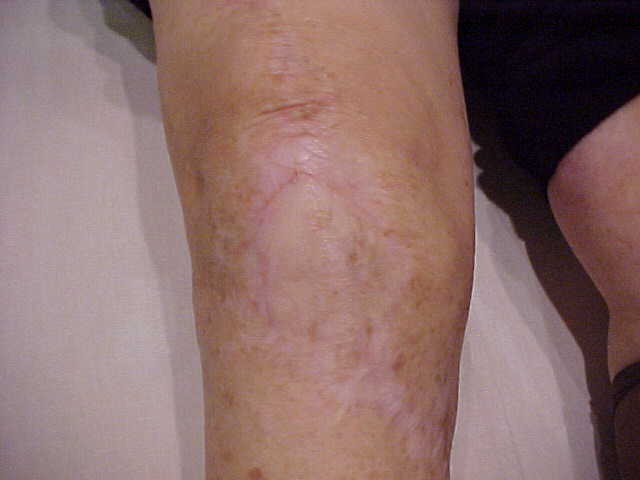
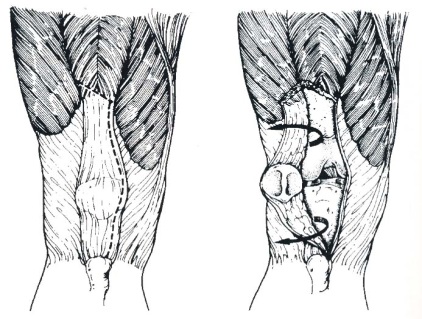
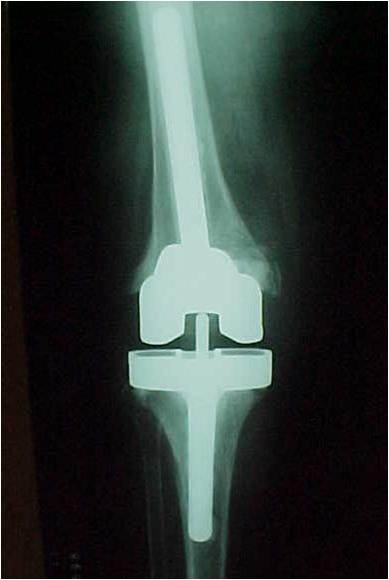
– Incisões prévias ? Cuidados para evitar necrose de pele (fig.5);
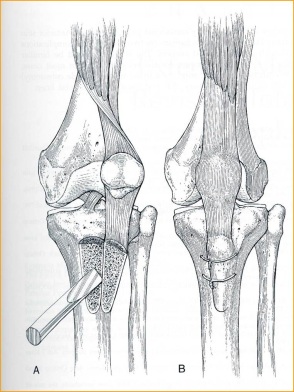
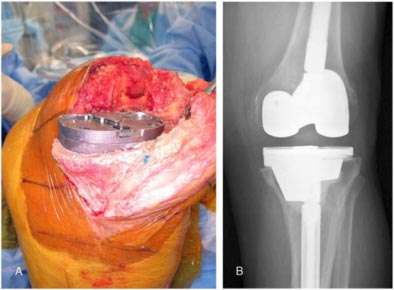
– Osteotomia da tuberosidade tibial (TAT) será necessária ? (fig.6-A-B). Fios de aço e/ou parafusos estão disponíveis para fixação ?
– A presença de um cirurgião plástico será necessária para possíveis coberturas e/ou retalhos cutâneos ?
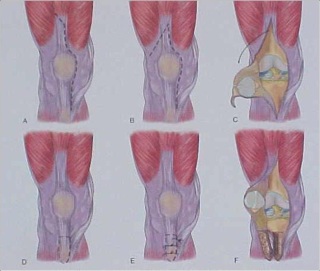
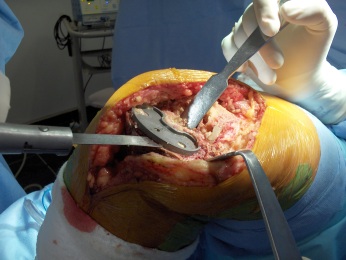
Remoção dos implantes prévios (fig.7 / 8-A-B / 9-A-B)
– Parafusos periarticulares – tipo de cabeça do parafuso ? Chave adequada disponível ?
– Instrumentos para remoção dos implantes / cimento ósseo – serra de Giglie, osteótomos finos e flexíveis, brocas, curetas – material especial para remoção do cimento ?
– Extratores dos componentes estão presentes ?

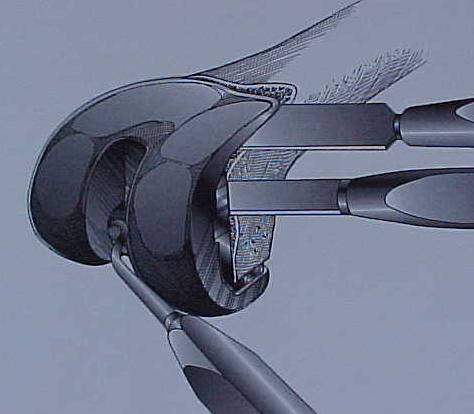
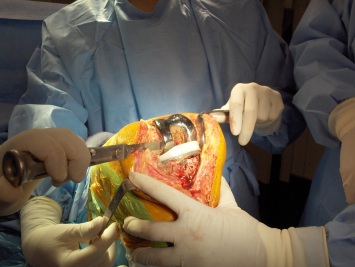

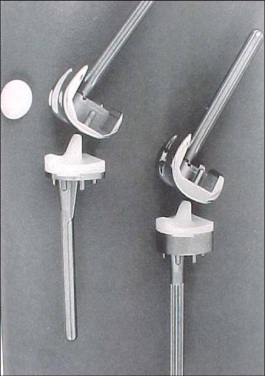
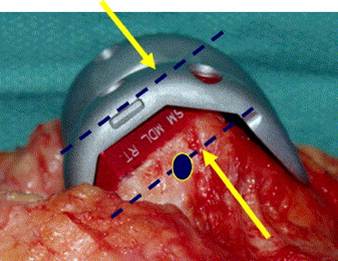
Implantes de revisão (fig.10-A-B)
– Que tamanho de componente femoral e tibial será necessário ? Que tipo de estabilidade (“constrição”) será utilizada ? O material de revisão permite esta customização ?
– Hastes / calços femorais e/ou tibiais serão necessários ? Diversos tamanhos disponíveis ?
– Implantes e hastes “offset” serão necessários e estão disponíveis

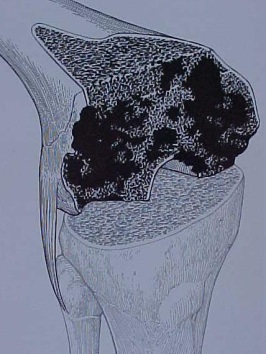
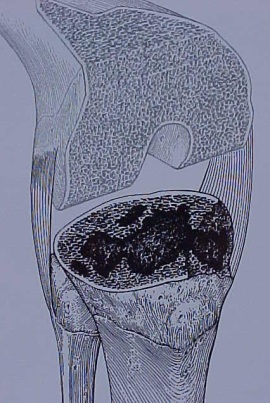
Enxerto ósseo
– Defeitos ósseos foram previamente avaliados ? (fig.11-A-B-C). NÃO esquecer que na cirurgia, com frequência os defeitos são maiores que aqueles observados nas radiografias;
– Tipo de enxerto necessário ? Estrutural – esponjoso ?
– Enxerto autólogo – homólogo (banco de osso disponível) ?
Diversos
– Sangue – reposição / autotransfusão / etc ?
– Imobilização pós-operatória (órtese / gesso) ?
Quando avaliamos com cuidado as possíveis causas de falha da ATJ primária e planejamos corretamente nossa cirurgia de revisão, podemos ter uma grande chance de sucesso neste procedimento difícil e complexo, obtendo-se resultados satisfatórios ao paciente, que é nosso principal objetivo no tratamento. (fig.12-A-B)

Técnica cirúrgica
Princípios
Os objetivos de uma revisão de ATJ incluem o alinhamento correto do membro inferior, posição e fixação adequada dos componentes, balanço ligamentar simétrico em flexão e extensão, mecanismo femoropatelar satisfatório e um aceitável arco de movimento final. Estes objetivos, em particular o balanço ligamentar e a fixação dos componentes da prótese dependem diretamente do correto manejo das perdas ósseas. A magnitude das perdas ósseas tem total implicação na decisão quanto ao uso de enxerto ósseo e/ou aumentos/calços nas próteses, escolha do tamanho dos componentes, necessidade de maior ou menor constrição e o uso ou não das hastes intramedulares.
Se não for possível ter acesso às radiografias em perfil do pré-operatório da cirurgia primária, devemos fazer esta radiografia do joelho contralateral para determinar o provável tamanho dos componentes. A altura da interlinha articular está 2 cm abaixo da origem do ligamento colateral medial e 2,5 cm abaixo da proeminência do epicôndilo lateral. Este dado é importante, pois se houver elevação da interlinha articular é muito provável que teremos problema de arco de movimento, com perda de alguns graus de flexão.
Exposição
Uma adequada exposição é essencial para o sucesso da reconstrução. A exposição deve permitir total visualização dos implantes, possibilidade de desbridamento dos tecidos moles e dos focos de osteólise, avaliação do estoque ósseo e reimplantação dos componentes de revisão. A exposição pode ser mais difícil na presença de artrofibrose, osso osteoporótico, patela baixa e obesidade.
O acesso e artrotomia parapatelar medial é mais comumente utilizado, entretanto, se houver acesso lateral prévio é recomendado repetí-lo para evitar possível osteonecrose da patela. Com frequência somente uma incisão foi usada previamente, e então esta incisão deve ser utilizada para a cirurgia de revisão. A incisão pode ser longitudinal anterior, medializada ou curvilínea. Se uma incisão transversa foi feita previamente, ela deve ser cruzada com ângulo mais aberto possível para minimizar complicações de pele dos bordos da incisão. Se existirem múltiplas incisões anteriores, normalmente a incisão mais lateral deve ser utilizada novamente, pois os vasos sanguíneos tem direção de medial para lateral ao joelho. Se não for possível refazer nenhuma das incisões antigas, devemos então deixar pelo menos 6 cm de pele entre a incisão antiga e a nova incisão.
Durante a exposição devemos recriar as goteiras mediais e laterais, liberar o fundo de saco suprapatelar de possíveis tecidos fibróticos para facilitar a mobilização do aparelho extensor. Se existir artrofibrose, podemos realizar uma quadricepsplastia para liberar o aparelho extensor da face anterior do fêmur. Na presença de aderências na região anterior da tíbia e parte proximal do tendão patelar, também devemos fazer liberações para permitir uma mobilização patelar adequada. A subluxação patelar normalmente é suficiente para uma boa exposição do joelho, não sendo necessária a eversão da patela. O aparelho extensor deve ser protegido durante todo o procedimento para evitar a avulsão iatrogênica do tendão patelar, que é desastrosa e de difícil solução. Fazemos uma liberação extensa do canto posteromedial para permitir a rotação externa e subluxação anterior da tíbia para remover o polietileno tibial. Após esta remoção do polietileno teremos melhores condições de mobilizar os tecidos moles com consequente maior facilidade de exposição.
Caso persista dificuldade de visualização e exposição dos componentes, podemos realizar um acesso tipo “quadríceps snip” (fig.13) que tornará mais fácil a exposição.
Se a exposição ainda persistir muito difícil e inadequada, podemos realizar uma osteotomia estendida da TAT conforme descrita por Whiteside (21). Esta osteotomia é muito útil na presença de patela baixa, na remoção de haste tibial cimentada e nos casos de mau funcionamento do aparelho extensor que necessitem de algum tipo de correção. É uma osteotomia longa (7-8 cm) onde devemos realizar um encaixe proximal para evitar a migração do fragmento (fig.14).
Os tecidos moles da parte lateral da osteotomia são deixados intactos. A osteotomia é fixada com 2-3 cerclagens com fios de aço em orientação oblíqua. Se o paciente tiver um bom estoque ósseo, não há necessidade de mudanças no programa de reabilitação no PO.
Na maioria dos casos de revisão de ATJ, a utilização dos acessos acima descritos é suficiente para uma boa exposição articular e reimplantação dos novos componentes. Em casos mais difíceis, porém excepcionais, podemos utilizar acessos mais agressivos tipo “medial femoral peel”, osteotomia epicondilar medial ou “V-Y turndown” do quadríceps.
Remoção dos componentes
Após uma adequada exposição, as interfaces cimento-osso-implante devem ser expostas para facilitar a remoção dos implantes. Os componentes podem ser removidos com osteótomos delgados, serra de Gigli ou serra óssea com lâminas pequenas e finas, sempre tendo em mente que devemos retirar a menor quantidade de osso possível, isto é, procurar preservar o estoque ósseo.
Todo o cimento ósseo deve ser removido, através de osteótomos especiais, brocas ou equipamentos de ultrassom.
Após a retirada dos componentes e do cimento, deve-se realizar o desbridamento extenso das partes moles e tecidos fibrosos que estejam aderidos ao osso residual.
A seguir utilizaremos as técnicas de reconstrução, com quatro principais procedimentos: reconstrução tibial, espaço em flexão, balanço em extensão e reconstrução femoropatelar.
Reconstrução tibial
Nós devemos iniciar a reconstrução pela plataforma tibial que afetará diretamente os espaços em flexão e extensão. É mais comum o uso de guias de corte intramedulares nas cirurgias de revisão, caso não existam grandes deformidades da tíbia. Se for necessário, podemos utilizar os guias extramedulares nas deformidades tibiais mais acentuadas. O corte da parte proximal da tíbia é feito com o guia a 0° (fig.15-A-B).

Fig.-15-A – Guia de corte tibial intramedular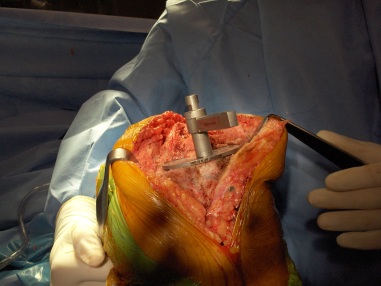
Nos pacientes com defeitos cavitários na região proximal da tíbia podem ser tratados com cimento ósseo (mais idosos) ou enxerto ósseo impactado (mais jovens), promovendo um bom suporte da base tibial na periferia do osso (23-24). Os enxertos maciços homólogos ou calços/cunhas metálicos devem ser usados nos grandes defeitos estruturais do planalto tibial (25-26). No geral, os calços/cunhas metálicos têm sido utilizados em maior escala pela facilidade de customização durante a cirurgia, facilidade de colocação e ausência de absorção. As próteses tumorais são reservadas para os casos de perda óssea severa, em pacientes idosos e de baixa demanda.
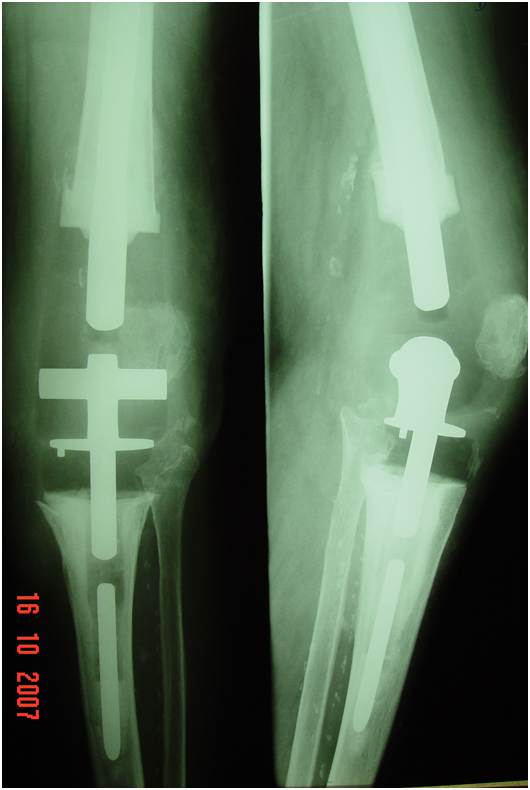
As hastes intramedulares de extensão devem ser utilizadas na maioria dos casos de reconstrução femoral ou tibial. As hastes transferem o estresse da parte deficiente para uma região diafisária mais distal (27). Elas também aumentam a área de superfície de fixação e podem orientar a direção do componente. No geral, o comprimento da haste deve ultrapassar o defeito metáfiso-diafisário. As hastes podem ser totalmente cimentadas (fig.16) ou ter uma fixação híbrida (fig.17), ou seja, a base tibial e a região metafisária são cimentadas e a extensão da haste é fixada de modo “press-fit” dentro do canal (28). A principal vantagem das hastes não cimentadas é a facilidade de remoção numa próxima cirurgia. As desvantagens das hastes não cimentadas incluem a dificuldade de uso nas tibiais com deformidades, dor potencial na extremidade da haste e a dificuldade de receber carga completa do planalto tibial. As hastes cimentadas aumentam a área para interdigitação, mas são mais difíceis de remoção. Elas não orientam o alinhamento, porém permitem alguns ajustes para melhor adaptação da superfície de corte do planalto tibial. As hastes com “offset” oferecem a vantagem adicional de melhor cobertura da tíbia e são comumente utilizadas não cimentadas.
Reconstrução femoral
A reconstrução femoral deve iniciar após a reconstrução tibial que irá servir de guia ou parâmetro para a rotação do componente femoral (fig.18).


Após a reconstrução com manutenção da altura da interlinha articular desejável é importante conseguir o balanço ligamentar correto em flexão e extensão através da espessura/tamanho mais adequado dos implantes.
Reconstrução patelar
O componente patelar deve ser bem exposto para melhor visualização da sua real situação. O implante deve ser mantido se estiver bem fixado, bem posicionado e ser compatível com os componentes da revisão. Se o implante estiver perdido (solto) deve ser retirado. Com o uso de serra óssea e lâmina de pouco espessura, retiramos a parte articular do componente patelar e com brocas de grande velocidade (“burrs”) removemos os “pegs” do componente e também o cimento ósseo residual. Se for possível e ainda existir estoque ósseo, deve-se fazer a colocação de novo componente patelar. Caso não seja possível a colocação de outro componente por falta de estoque ósseo (menor que 10 mm de espessura), a pateloplastia é realizada com regularização do osso remanescente (32). Muitas vezes, chega a ser surpreendente o bom resultado funcional no pós-operatório com a pateloplastia (fig.22).

Reconstrução das perdas ósseas
Um ponto crítico nas revisões de ATJ é a determinação da extensão e localização da perda óssea. Após a remoção dos componentes é importante verificar se os defeitos são “contidos” ou “não contidos” (segmentares). A localização de osso de suporte e os arredores das perdas ósseas são essenciais para determinar que tipo e tamanho da reconstrução que será necessária (9). Os defeitos pequenos podem ser preenchidos com cimento e parafusos ou enxerto ósseo autólogo ou homólogo moído, particularmente nos pacientes mais idosos. Entretanto, nos defeitos maiores ou estruturais serão necessárias medidas reconstrutivas maiores, como blocos/calços modulares como aumentos, enxerto ósseo homólogo maciço, cones metálicos altamente porosos metafisários (“tantalum”) ou “sleeves” metafisários.
Cimento ósseo e parafusos
O uso do cimento com parafusos é simples, de baixo custo e eficiente. Este método é mais usado nos defeitos menores que 5 mm de profundidade. A armação com o uso adicional de parafusos aumenta as propriedades biomecânicas estruturais (fig.23).
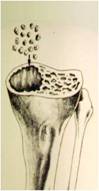
Enxerto ósseo moído
Este método é utilizado em defeitos “contidos” e particularmente em pacientes mais jovens onde é importante preservar o estoque ósseo. Pode ser autólogo ou homólogo, com taxas similares de incorporação (fig.24-A,B) É importante que a superfície que irá receber o enxerto tenha boa vascularização para facilitar a incorporação. Caso o osso residual esteja corticalizado, podemos utilizar as brocas (“burrs”) para chegarmos ao osso esponjoso e com boa vascularização. Se isto não for possível, devemos então utilizar outros métodos para a reconstrução.
no planalto tibial medial.
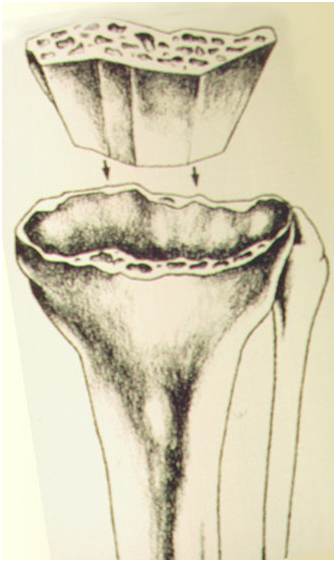
Enxerto ósseo homólogo estrutural
Os enxertos ósseos estruturais homólogos são comumente utilizados na reconstrução de grandes defeitos ósseos na intenção de promover suporte mecânico das reconstruções ósseas. Eles são indicações em defeitos acima de 15 mm de profundidade e que excedem as dimensões dos blocos/calços metálicos. A vantagem deste enxerto é o seu potencial de reconstrução, principalmente em jovens. As desvantagens são o potencial de reabsorção do enxerto, colapso e a não incorporação ou união pelo hospedeiro. Quando indicamos este tipo de enxerto, devemos levar em consideração as condições de saúde geral do paciente, idade psicológica, qualidade óssea e nível de atividade (fig.25-A-B).
Reconstrução com blocos/calços metálicos
As reconstruções com blocos/calços metálicos são indicadas em defeitos femorais / tibiais pequenos ou moderados (fig.26-A-B-C).

Fig.26-A – Defeito moderado no fêmur e tíbia – pér-operatório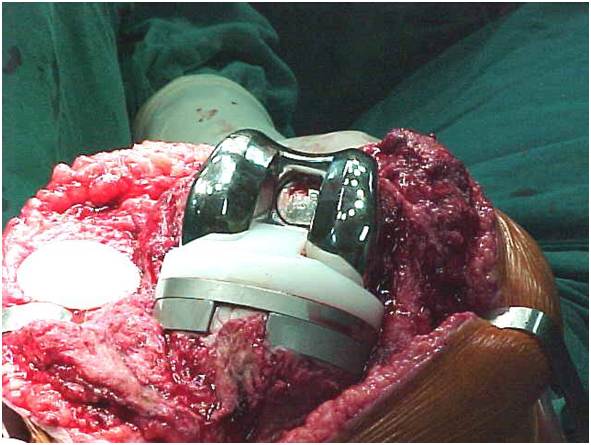
Reconstrução com cones metálicos altamente porosos e “sleeves” metáfisários
Estes materiais foram desenvolvidos recentemente e indicados para os grandes defeitos no fêmur e/ou tíbia. Eles foram desenhados para evitar possível falhas na incorporação ou reabsorção dos enxertos estruturais homólogos, Os metais altamente porosos, em particular o ”tantalum” (fig.27-A), são biomateriais com várias vantagens potenciais sobre os materiais tradicionais, incluindo baixa dureza, alta porosidade e alto coeficiente de fricção (9). Os desenhos destes cones metafisários foram desenvolvidos para preencher as diversas formas de perdas ósseas encontradas nas revisões de ATJ (fig.27-B) e providenciar suporte mecânico com integração biológica (33-34).

Long e Scuderi (34)
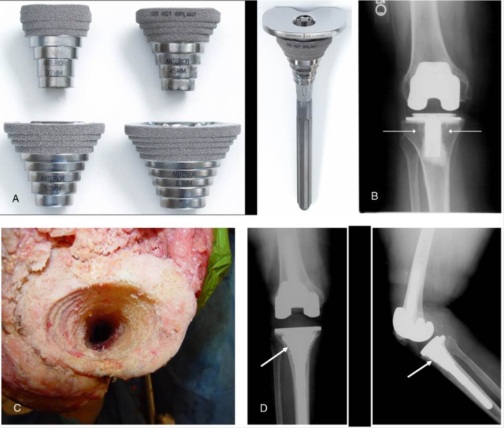
Reconstrução com próteses “tumorais”
Este tipo de reconstrução é de indicação excepcional, sendo considerada “cirurgia de salvação” (fig.29). A indicação seria nos casos extremamente graves, com instabilidade e perdas ósseas que são impossíveis de reconstrução através de todas as outras formas descritas acima. Elas são indicadas em pacientes idosos e de baixa demanda, pois há muita sobrecarga sobre o implante e o osso remanescente, com grande possibilidade de falha nos pacientes mais jovens e ativos.
Estabilidade final
Após a inserção do componente femoral e tibial, o joelho deve ser avaliado em todo arco de movimento para que possamos avaliar a estabilidade da reconstrução. O joelho deve ter extensão completa e a patela deve excursionar bem centrada em todo arco de movimento. A estabilidade deve ser testada em extensão completa, flexão intermediária e flexão completa. A estabilidade deve ser adequada tanto no plano coronal como sagital e com frequência isto é obtido através de implantes que não necessitem constrição excessiva. Para as instabilidades unidirecionais ou com leve alteração na flexo-extensão, normalmente um “poste” mais alto para estabilização posterior é suficiente. Nós devemos utilizar implantes com a menor constrição possível, para evitar sobrecarga no manto de cimento. As extensões com hastes intramedulares devem ser consideradas sempre que o grau de constrição aumenta. As próteses mais constritas, tipo dobradiças (“hinge”) devem ser reservadas para os pacientes com marcada instabilidade em flexão e extensão, instabilidade global ou recurvato não controlado.
Inserção dos componentes
A técnica de inserção dos componentes depende do modo de fixação das hastes intramedulares. Se for utilizada uma haste cimentada, devemos usar um restritor de canal para boa pressurização do cimento e evitar o extravasamento distal no canal. O cimento deve ser aplicado na superfície dos componentes femoral e tibial, bem como ao longo da região metafisária dos ossos. Se houver osso cortical, devemos realizar perfurações para melhorar a penetração do cimento com melhor fixação. A rotação deve ser sempre observada durante todo o processo de fixação dos componentes, para se evitar qualquer rotação interna inadvertida.
Método preferido pelos autores
Dentro do que foi exposto anteriormente, nossa técnica cirúrgica é resumida nos seguintes passos:
– Acesso anterior e artrotomia parapatelar medial;
– Quando necessário utilizamos prolongamentos do acesso com “quadríceps snip” ou osteotomia da TAT;
– Sinoviectomia extensa com exposição adequada dos componentes;
– Retirada dos componentes com uso de serra de Gigli, osteótomos finos e flexíveis, serra óssea com lâmina delgada e impactores;
– Colheita de 4-5 amostras de tecidos para cultura (líquido sinovial / tecido sinovial / tecido óoseo do fêmur / tíbia), após a retirada dos componentes;
– Reconstrução óssea tibial em primeiro lugar, que servirá como base para a reconstrução femoral (segundo lugar);
– Uso de blocos/calços metálicos como preferência. Nas grandes perdas ósseas utilizamos enxerto ósseo homólogo associado;
– As hastes são híbridas de preferência, cimentando a superfície do componente e a região metafisária, com fixação da haste tipo “press fit”;
– Reconstrução patelar por último. Se não for possível a colocação de outro componente, fazemos somente a pateloplastia do osso remanescente;
– Cimento com antibiótico já misturado de fábrica;
– Limpeza extensa de todo sítio cirúrgico com “kit” de lavagem com pressão;
– Sutura dos tecidos em flexão do joelho, para ganho de mobilidade no pós-operatório;
– Dreno de sucção por 24 horas;
– Antibiótico no pós-operatório até termos os resultados das culturas;
– Profilaxia mecânica e medicamentosa contra tromboembolismo venoso por 14 dias;
– Apoio parcial do membro operado em 24-48 horas com auxílio de andador ou muletas, se a reconstrução for satisfatória;
– Início de reabilitação em clínica especializada após a retirada dos pontos, em torno de 14 dias.
Discussão e conclusões
As cirurgias de revisão de ATJ são desafiadoras para qualquer cirurgião e podem estar associadas a complicações, principalmente a infecção periprotética. Mas, através da avaliação sistemática que inclui uma boa história, um bom exame físico, radiografias adequadas e testes sorológicos, teremos a capacidade de identificar de maneira correta a etiologia da falha na maioria dos casos. Sempre devemos fazer o possível para identificar ou afastar qualquer possibilidade de infecção. A causa da falha com diagnóstico correto nos levará a um planejamento adequado para uma cirurgia bem sucedida.
Todos os detalhes do procedimento, como uma exposição correta, liberação posteromedial extensa e associação de prolongamentos tipo “quadríceps snip” ou osteotomia da TAT são importantes para iniciar a reconstrução óssea e ligamentar. Devemos minimizar as perdas ósseas no momento da retirada dos componentes. O uso de blocos ou aumentos metálicos, bem como enxerto ósseo homólogo nos permitem reconstruções ósseas muito satisfatórias. Os implantes devem ter o mínimo de constrição possível, deixando para aumentar a constrição somente nos casos excepcionais com defeitos e instabilidade muito acentuada.
Finalmente, devemos sempre ter em mente a possiblidade de infecção, uma vez que o procedimento padrão nestes casos será totalmente diferente, com a reconstrução devendo ser realizada em dois tempos.
Bibliografia
- Ranawat CS, Flynn WF Jr, Saddler S, Hansraj KK, Maynard MJ. Long-term results of the total condylar knee arthroplasty. A 15-year survivorship study. Clin Orthop Relat Res. 1993;286:94-102.
- Ritter MA, Berend ME, Meding JB, Keating EM, 1993;286: 94-102. Faris PM, Crites BM. Long-term followup of anatomic graduated components posterior cruciate-retaining total knee replacement. Clin Orthop Relat Res. 2001;388:51-57.
- Kurtz S, Ong K, Lau E, Mowat F, Halpern M: Projections of primary and revisions hip and knee arthroplasty in the United States from 2005 to 2030. J Bone Joint Surg Am 2007;89(4):780-785.
- Jacofsky DJ, Della Valle CJ, Meneghini RM, Sporer SM, Cercek RM. Revision total knee arthroplasty: What the practicing orthopaedic surgeon needs to know. J Bone Joint Surg Am 2010;92(5):1282-1292.
- Mont MA, Sema FK, Krackow KA, Hungerford DS. Exploration of radiographically normal total knee replacements for unexplained pain. Clin Orthop Relat Res.1996;331:216-220.
- Fehring TK, Odum S, Griffin WL, Mason JB, Nadaud M. Early failures in total knee arthroplasty. Clin Orthop Relat Res. 2001;392:315-318.
- Mulhall KJ, Ghomrawi HM, Scully S, Callaghan JJ, Saleh KJ. Current etiologies and modes of failure in total knee revision. Clin Orthop Relat Res. 2006;446:45-50.
- Sharkey PF, Hozack WJ, Rothman RH, Shastri S, Jacoby SM. Insall Award paper: Why are total knee arthroplasty failing today? Clin Arthop Relat Res. 2002;404:7-13.
- Meneghini RM. Revision total knee arthroplasty. In Orthopaedic Knowledge Update: Hip and Knee Reconstruction 4 – AAOS. 2011: 165-175
- Meding JB, Keating EM, Ritter MA, Faris PM, Berend ME, Malinzak RA. The planovalgus foot: a harbinger of failure of posterior cruciate-retaining total knee arthroplasty. J Bone Joint Surg Am. 2005;87 Suppl 2:59-62.
- Vessely MB, Frick MA, Oakes D, Wenger DE, Berry DJ. Magnetic resonance imaging with metal suppression for evaluation of periprosthetic osteolysis after total knee arthroplasty. J Arthroplasty. 2006;21:826-831.
- Berger RA, Crossett LS, Jacobs JJ, Rubash HE. Malrotation causing patellofemoral complications after total knee arthroplasty. Clin Orthop Relat Res. 1998;356:144-153.
- Hofmann AA, Wyatt RW, Daniels AU, Armstrong L, Alazraki N, Taylor A Jr. Bone scans after total knee arthroplasty in asymptomatic patients. Cemented versus cementless. Clin Orthop Relat Res. 1990;251:183-188.
- Schinsky MF, Della Valle CJ, Sporer SM, Paprosky WG. Perioperative testing for joint infection in patients undergoing revision total hip arthroplasty. J Bone Joint Surg Am. 2008;90:1869-1875.
- Ghanem E, Parvizi, Burnett RS et al. Cell count and differential of aspirated fluid in the diagnosis of infection at the site of total knee arthroplasty. J Bone Joint Surg Am. 2008;90(8):1637-1643.
- Barrack RL, Jennings RW, Wolfe MW, Bertot AJ. The value of perioperative aspiration before total knee revision. Clin Orthop Relat Res. 1997;345:8-16.
- Della Valle CJ, Sporer SM, Jacobs JJ, Berger RA, Rosenberg AG, Paprosky WG. Preoperative testing for sepsis before revision total knee arthroplasty. J Arthroplasty. 2007;22(6 Suppl 2):90-93.
- Lonner JH, Desai P, Dicesare PE, Steiner G, Zuckerman JD. The reability of analisys of intraoperative frozen sections for identifying active infection during revision hip or knee arthroplasty. J Bone Joint Surg Am. 1996;78:1553-1558.
- Engh GA et Rorabeck CH. Planning the revision surgery and Bone defect classification. In: Revision Total Knee Arthroplasty. Williams & Wilkins, 1997.63-182
- Meek RM, Greidanus NV, McGraw RW, Masri BA. The extensile rectus snip exposure in revision of total knee arthroplasty. J Bone Joint Surg Br. 2003;85:1120-1122.
- Whiteside LA. Exposure in difficult total knee arthroplasty using tibial tubercle osteotomy. Clin Orthop Relat Res. 1995;321:32-25.
- Whittaker JP, Dharmarajan R, Toms AD. The management of bone loss in revision total knee replacement. J Bone Joint Surg Br. 2008;90:981-987.
- Bush JL, Wilson JB, Vail TP. Management of bone loss in revision total knee arthroplasty. Clin Orthop Relat Res. 2006;452:186-192.
- Lonner JH, Lotke PA, Kim J, Nelson C. Impaction grafting and wire mesh for uncontained defects in revision knee arthroplasty. Clin Orthop Relat Res. 2002;404:145-151.
- Engh GA, Ammeen DJ. Use of structural allograft in revision total knee arthroplasty in knees with severe tibial bone loss. J Bone Joint Surg Am. 2007;89:2640-2647.
- Long WJ. Scuderi GR. Porous tantalum cones for large metaphyseal tibial defects in revision total knee arthroplasty: a minimum 2-year follow-up. J Arthroplasty. 2009;24:1086-1092.
- Bourne RB. Finlay JB. The influence of tibial component intramedullary stems and implant-cortex contact on the strain distribution of the proximal tibia following total knee arthroplasty. An in vitro study. Clin Orthop Relat Res. 1986;208:95-99.
- Peters CL, Erickson J, Kloepper RG, Mohr RA. Revision total knee arthroplasty with modular components inserted with metaphyseal cement and stems without cement. J Arthroplasty. 2005;20:302-308.
- Mahoney OM, Kinsey TL. Modular femoral offset stems facilitate joint line restoration in revision knee arthroplasty. Clin Orthop Relat Res. 2006;446:93-98.
- Porteous AJ, Hassaballa MA,Newman JH. Does the joint line matter in revision total knee replacement ? J Bone Joint Surg Br. 2008;90:879-884.
- Bottros J, Gad B, Krebs V, Barsoum WK. Gap balancing in total knee arthroplasty.
J Arthroplasty. 2006.21(4 Suppl 1):11-15.
- Rorabeck CH, Mehin R, Barrack RL. Patellar options in revision total knee arthroplasty. Clin Ortop Relat Res. 2003;41:84-92.
- Meneghini RM, Lewallen DG, Hanssen AD. Use of porous tantalum metaphyseal cones for severe tibial bone loss during revision total knee replacement. J Bone Joint Surg Am. 2008;90(1):78-84.
- Long WJ, Scuderi GR. Porous tantalum cones for large metaphyseal tibial defects in revision total knee arthroplasty. J Arthroplasty. 2009;24(7):1086-1092..
- Dennis DA. A stepwise approach to revision total knee arthroplasty. J Arthroplasty. 2007;22(4 Suppl):32-38.